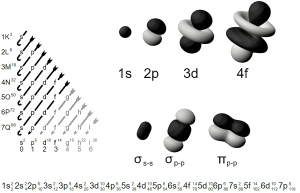
Orbitales atómicos
Estos, para las personas que desconocen del tema, se podrían considerar como galaxias enérgicas, para simplificar el hecho, cada orbital atómico posee una forma variada dependiendo de la categoría que posea, y de ahí nace la que sería su energía, cada orbital es único e inigualable, en la química estos se comparan con las neuronas o las células.
Temas relacionados
Configuración electrónica, electrones de valencia, fracción molar, masa atómica, número atómico, número másico, peso atómico, órbita
¿Qué son los orbitales atómicos?
Se considera orbital atómico a la región de un espacio definido en concreto que se determina por una solución en particular, es decir, tiene su propia secuencia matemática única y singular, es totalmente independiente del tiempo.
Forma de los orbitales atómicos
Hay diversas formas para lo orbitales atómicos y estos van en el siguiente orden:
Orbital S
Es totalmente simétrico y esférico, envolviendo de esta forma al núcleo atómico, se crea inicial mente por una nube eléctrica que paulatinamente se convierte en lo que sería la esfera.
Orbital P
Estos poseen una forma geométrica más chata y aplanada, conformada por dos semi esferas que se asemejan a las olivas y poseen un punto de colisión o el punto de contacto, el cual es el núcleo atómico, se orientan dependiendo los ejes de coordenadas.
Orbital D
Estos orbitales se podría decir que son más diversos, independientes y únicos, ya que su forma posee aleatorias direcciones, se divide en cuatro partes que en un extremo son ovalados y en el otro puntiagudo, dándole una forma como piramidal, estas partes están orientadas hacia diferentes planos del espacio respectivamente, hasta unirse por causa de la energía que emite cada parte dividida, quedando solamente dos figuras cónicas atravesadas en el medio por un pequeño aro, que anteriormente fue creado partiendo de las otras dos partes, a este aro se le reconoce como doble cono nodal.
Orbital F
Estos orbitales son más complejos aun, cuentan con una figura compleja y exótica, aunado a ello, poseen 4 nodos radiales.
Características
De entre de las características principales de los orbitales atómicos están:
- Dentro de cualquiera de los orbitales atómicos, todos sus orbitales del mismo número cuántico presentan siempre un tamaño casi igual entre sí a nivel molecular
- En los átomos, los valores de gran tamaño tiene una extraña relación con los orbitales de gran tamaño.
- A medida que aumenta la carga nuclear dentro de la carga orbital, este va reduciendo su tamaño constantemente.
- Estos presentan según sus formas, siluetas similares a un conjunto de globos de diferentes tamaños, en diferentes direcciones.
Energía
Los niveles de energía electrónica dentro de un orbital atómico se basan a través de un sistema de capa. A medida que una capa se acerca al núcleo menor este será el número cuántico principal, esto da a entender que a medida que el número cuanto principal se eleve esta será la distancia existen entre el electrón y el centro del átomo.
Por lo general cada orbital cuenta con dos electrones, pero existe una particularidad que determina la configuración de los mismos dentro de un átomo y es que son los giros opuestos las cuales lo configuran su polaridad.
Hibridación de orbitales atómicos
La hibridación se considera una interacción que conlleva a la reproducción de los orbitales atómicos, estos se unen entre sí, así como las células, y se reproducen creando de esta manera orbitales híbridos; esta reproducción dependerá del tipo de orbital atómico al que nos refiramos.
Tipos de orbitales atómicos
Entre los orbitales atómicos podemos encontrar:
- Sharp.
- Principal.
- Difuse.
- Fundamental.
Cómo se simbolizan los orbitales atómicos
Los orbitales atómicos presentan una simbología diferente para cada tipo los cuales se separan según su forma, estos a su vez se relacionan directamente con las líneas espectrales, siendo su simbología la primera letra de la palabra en ingles.
- Para l = 0, orbitales s. (su palabra en ingles es Sharp)
- Para l = 1, orbitales p. (su palabra en ingles es Principal)
- Para l = 2, orbitales d. (su palabra en inglés es Diffuse)
- Para l = 3, orbitales f. (su palabra en ingles es Fundamental)
- Para l = 4, orbitales g. (a partir de este punto se continua en orden alfabético)
Cuántos orbitales atómicos son posibles para un subnivel electrónico dado
Para comprender correctamente cuantos orbitales atómicos son posible, la mejor manera es establecerlo en un cuadro de la siguiente manera:
Nivel | Subnivel | Orbital | spin | Nº de electrones |
N=1 | 1=0 -> s | Mi=0 (1 valor 1s) 1s | -1/2 +1/2 | 2 |
N=2 | 1=0 -> s 1=1 -> p | Mi=0 (1 valor 1s) 2s Mi=1,0+1 (3v) 2p | -1/2 +1/2 | 2 6 |
| N=3 | 1=0 -> s 1=1 -> p 1=2 -> d | Mi=0 (1 valor 1s) 3s Mi=1,0+1 (3v) 3p Mi=2,-1,0+1,+2 (5v) 3d | -1/2 +1/2 | 2 6 10 |
| N=4 | 1=0 -> s 1=1 -> p 1=2 -> d 1=3 -> f | Mi=0 (1 valor 1s) 4s Mi=1,0+1 (3v) 4p Mi=2,-1,0+1,+2 (5v) 4d Mi=3,-2,-1,01,2,3 (5v) 4d | -1/2 +1/2 | 2 6 10 14 |
Ejemplos
Si se estudia el elemento de la tabla periódica “neón”, este cuenta con una capa llena de orbitales de 2s y 2p lo cual se estructuraría de la siguiente manera:
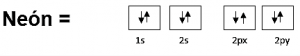
Para desglosar al orbital atómico de la tercera fila, se ingresa un orbital D, esto se debe a que existe un enlace covalente del ion, en la mayoría de los casos los orbitales de este tipo se descartan, pero aquí entra en juego por su similitud en capas de sus orbitales. Al desglosar el de la tercera fila el neón quedara con 2s y 1p, esto con el fin de reducir su carga nuclear y aumentar su energía electrónica.
Importancia
Aunque el tema es sumamente complejo para quienes los desconocen, estos orbitales han demostrado ser de alta utilidad para los químicos ya que no solo cumplen funciones dentro de los sistemas polielectrónicos, sino que a su vez también se le incluye dentro de los sistemas polinucleares.
A su vez, en cuanto a los especialistas en matemáticas les ha facilitado en gran manera explicar de forma coherente lo que es los estados estacionarios de un electrón dentro de un campo eléctrico con respecto a la mecánica cuántica.
¿Cómo citar este artículo?
Calderón, Grecia. (2019). Orbitales atómicos. Recuperado el 24 febrero, 2024, de Euston96: https://www.euston96.com/orbitales-atomicos/