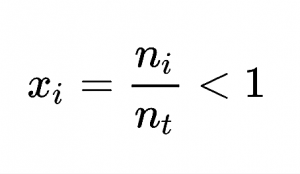Fracción molar
La fracción molar es una unidad de concentración que se define como la igualdad en el número de moles de un componente dividido por el número total de moles de una solución. Debido a que es una proporción, es una expresión sin unidades. La fracción molar de todos los componentes de una solución, cuando se suman, será igual a 1 y es considerada como una unidad de concentración adimensional.
¿Qué es la fracción molar?
Es una unidad del área de la química que se utiliza para poder expresar la concentración que existe en un soluto o en una disolución. Es el cociente que hay entre los moles de soluto y el total de los moles que hay en la disolución.
Para qué se usa
Las fracciones molares son utilizadas para poder expresar por medio de ellas la concentración que tiene un soluto en un solvente. Nos ayudan a expresar la proporción en la que se encuentran los moles que tiene un soluto con respecto a los moles totales que se encuentran dentro de la solución y que se calculan sumando los moles de los solutos y de los disolventes.
También es utilizada para expresar la concentración que hay en la relación de la presión de vapor en las disoluciones diluidas y los ideales de sólidos en los líquidos, en el estudio del equilibrio que se da entre los líquidos y los vapores de las soluciones de los líquidos.
Fórmula
La fórmula para averiguar la fracción molar de un gas es la siguiente:
Fracción molar (Xi) = ni (moles de sustancia) / nt (moles totales de la disolución)
Donde x es el soluto y n es el número de moles que tiene el soluto medido en moles.
Fracción molar de un gas
La ley de los gases ideales nos dice que todos los gases se comportan de una manera idéntica y que su comportamiento es independiente de las fuerzas atractivas y repulsivas. Si el volumen y la temperatura se mantienen constantes, la ecuación del gas ideal puede reordenarse para mostrar que la presión de una muestra de gas es directamente proporcional a la cantidad de moles de gas presentes.
P = n ( RT / V ) = n x const
Fracción molar de un soluto
La fracción molar del soluto (F1) es la relación que existe entre el número de moles del soluto (n1) y el número de moles de la solución (n1+ n2).
Fracción molar de un solvente
La fracción molar de un solvente (F2) es la relación que hay entre el número de moles del solvente (n2) y el número de moles de la solución (n1+ n2).
Siendo: F1 = fracción molar del soluto y F2 = fracción molar del solvente
n1 = número de moles del soluto.
n2 = número de moles del solvente.
n = número de moles de la solución ( n1 + n2 ).
La suma de la fracción molar del soluto (n1) y de la fracción molar del solvente (n2) todo el tiempo deberá de ser igual a uno.
F1 + F2 = 1
El número de moles se obtiene a través de la aplicación de la relación de la masa por el mol.
Ejemplos
Algunos ejemplos de fracciones molares ya resueltos son los siguientes:
Ejemplo 1
Calcular la fracción molar de cada una de las sustancias de la disolución de: 10 moles de metanol, 1 mol de etanol y 8 moles de agua.
nt = moles totales de la disolución = nmetanol + netanol + netanol = 10 + 1+ 8 = 19
xmetanol = nmetanol / nt = 10 / 19 = 0,53
xetanol = netanol / nt = 1 / 19 = 0,05
xagua = netanol / nt = 8 / 19 = 0,42
Podemos comprobar que la solución es correcta ya que la suma de las tres es igual a 1: xmetanol + xetanol + xagua = 0,53 + 0,05 + 0,42 = 1
Ejemplo 2
Calcular la fracción molar de cada componente de una disolución de 40 gramos de alcohol etílico (CH3CH2OH) y 100 gramos de agua.
peso molecular del alcohol etílico = 46 g / mol
peso molecular del agua = 18 g / mol
moles de alcohol etílico = nalcohol et. = 40 g / 46 g · mol-1 = 0,87 moles
moles de agua = nagua = 100 g / 18 g · mol-1 = 5,56 moles
moles totales disolución = nt = 0,87 + 5,56 = 6,43 moles
fracción molar del alcohol etílico = xalcohol et. = nalcohol et. / nt = 0,87 / 6,43 = 0,14
fracción molar del agua = xagua = nagua / nt = 5,56 / 6,43 = 0,86
verificamos que la solución es correcta: xalcohol et. + xagua = 0,14 + 0,86 = 1
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Fracción molar. Recuperado el 25 febrero, 2024, de Euston96: https://www.euston96.com/fraccion-molar/