Masa atómica
Las sustancias que podemos observar ocupan un espacio y también tienen masa. Las moléculas, que son las partes que constituyen las sustancias, a menudo deben medirse por medio de experimentos, y es importante que estas medidas sean precisas. Pero ¿cómo podemos medir algo tan pequeño de manera precisa? ¿Cómo medimos normalmente las moléculas?

- Simbolo: u o Da
- Unidad: Unidad de masa atómica o Dalton
¿Qué es la masa atómica?
La masa atómica es la masa que tiene un átomo cuando se encuentra en reposo, es la que surge del total de masa de protones y neutrones de un único átomo también en reposo.
En los diferentes laboratorios, se usa una herramienta llamada balance analítico para medir en gramos. A través de un cálculo cuidadoso, los científicos pueden determinar la cantidad de moles que necesitará una reacción específica. Un mol es una unidad de medida que nos ayuda a hacer comparaciones entre partículas de cualquier sustancia dada y su masa. Si ya sabemos la cantidad de moles que necesitamos, podemos usar el concepto de masa molar para calcular cuántos gramos de la sustancia se requieren. La masa molar, también conocida como peso molecular, es la suma de la masa total en gramos de todos los átomos que componen una molécula particular. La unidad utilizada para medir es gramos por mol.
Historia
El primero científico que estudió el peso atómico y que lo calculó fuer el químico inglés John Dalton. Ha sido conocido por haber desarrollado una teoría en este sentido que se sustentaba en cinco puntos fundamentales. Además de John Dalton, Jöns Jakob Berzelius, un químico sueco que también realizó varios cálculos y que, junto al anterior científico, está considerado como el padre de la química moderna. Polímero, catálisis o isómero fueron algunos de los conceptos que este acuñó y que introdujo en dicha ciencia.
Qué representa la masa atómica
La masa atómica representa la cantidad de diferentes isótopos que se pueden encontrar en un mismo elemento, pero que difieren entre sí y es al mismo tiempo una de las propiedades fundamentales que tienen los átomos, tales como el número y la masa. Algunas veces encontramos que existe un isótopo que más común que otros, y la diferencia que hay entre su masa atómica y la masa atómica relativa o peso atómico estándar es suficientemente pequeña que no afecta los cálculos, pero esta diferencia puede ser importante en otros casos.
Cómo se representa
La masa atómica de los elementos se encuentra representada en la tabla periódica de los elementos por medio de la letra A. Es representado por medio del número másico y este número es el que nos indica el número total de partículas que se pueden encontrar en el núcleo, en otras palabras la suma y de los neutrones y de los protones. Se encarga de representar la masa que tiene el átomo medida en u.m.a. En algunas ocasiones es también conocida con el nombre de peso atómico, sin embargo, es importante mencionar que este nombre es incorrecto ya que la masa es una propiedad específica del cuerpo, en cambio el peso, es una característica que va a depender en su totalidad del peso.
Cómo se mide la masa atómica
La unidad en la que se mide la masa atómica se llama justamente así, unidad de masa atómica y se representa por medio de las siglas u.m.a. Esta unidad es también llamada Dalton, y se representa con la palabra Da, la cual fue dada en honor al químico John Dalton. La u.m.a corresponde a la doceava parte de la masa del núcleo del carbono-12, que es el isótopo más abundante de este elemento. El valor de una u.m.a es también muy cercano a la masa de un protón. La medición de las masas de los elementos puede ser realizada por medio de un espectrómetro de masas. La unidad científica para manejar los átomos en cantidades macroscópicas se conoce con el nombre de mol.
Cómo se calcula la masa atómica
La masa atómica se puede calcular sumando los números de neutrones y los protones o electrones de un elemento determinado. También pueden ser calculadas con las medidas ponderadas de las masas de los diferentes isotopos que constituyen cada elemento.
Ejemplos
- Masa atómica del oxígeno: En el caso del hidrógeno, indica masa atómica del H = 1,00797, debemos leer que la masa de un átomo de H es 1,00797 veces mayor que la u.m.a., pero no que la masa de un átomo de H es 1,00797 g.
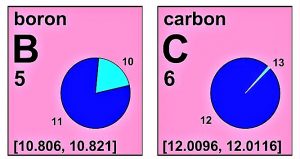
- Masa atómica del carbono: El carbono natural es una mezcla de tres isótopos, 98,892 % de 12 C y 1,108 % de 13 C y una cantidad mínima de 14 C. Por lo tanto, la masa atómica promedio del carbono será: (0,98892) x (12 u.m.a) + (0,01108) x (13,00335 u.m.a) = 12,011 u.m.a.
- Algunas otras masas atómicas son: Calcio 40.087, Cobalto 58,933195, Cobre 63,564, Flúor 18,998403 y hierro 55,845.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Masa atómica. Recuperado el 22 febrero, 2024, de Euston96: https://www.euston96.com/masa-atomica/