Peróxidos
La palabra peróxido es utilizada de manera muy amplia dentro del campo de la química con el objetivo de poder nombrar a aquellos óxidos que poseen un número más elevado de oxígeno. Recordemos que los óxidos son todos los compuestos que están formados por la combinación del oxígeno con un metal o con un metaloide.
¿Qué son los peróxidos?
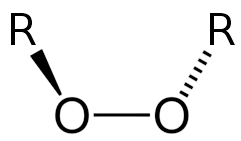
Los peróxidos son básicamente todos aquellos óxidos en los cuales se puede encontrar una proporción mayor de oxígeno dentro de la molécula y en donde existen dos átomos de oxígeno que están entrelazados entre sí.
Características de los peróxidos
Entre las principales características de los peróxidos mencionamos las siguientes:
- Pueden ser nombrados siguiendo las reglas de la nomenclatura tradicional la que indica que primeramente se colocará la palabra peróxido y luego el elemento metálico, tomando siempre en cuenta la valencia.
- Sus átomos de oxígeno se unen gracias a un enlace de tipo covalente.
- También poseen dos electrones que no se encuentran unidos y dos cargas de tipo negativas.
- Tienen la capacidad de comportarse como sustancias oxidantes.
- Pueden provocar incendios importantes si entran en contacto con materiales combustibles.
- Su nombre se obtiene leyendo la fórmula desde la derecha hacia la izquierda.
- Es considerado como un hidruro derivado.
Historia
El peróxido de hidrógeno fue identificado por primera vez en el año 1818 cuando Louis Jacques Thénard hizo reaccionar el peróxido de bario con ácido nítrico. Una versión mejorada de este proceso utilizó ácido clorhídrico, seguido de ácido sulfúrico para acelerar el subproducto de cloruro de bario. El proceso de Thénard se utilizó desde finales del siglo XIX hasta mediados del siglo XX. Y con el paso del tiempo los métodos de fabricación modernos han evolucionado de forma importante convirtiendo esta sustancia en un componente elemental de muchos productos.
Quién los descubrió
Su descubrimiento fue realizado por primera vez por L. J. Thénard, un químico de nacionalidad francesa en el año 1818. Su descubrimiento se basó en la investigación de la forma en la que actuaban algunos ácidos en el peróxido de bario.
Tipos de peróxidos
Existen los siguientes tipos de peróxidos:
- Peróxidos orgánicos: son un tipo de compuesto orgánico formados por el grupo funcional peróxido y se utilizan para el proceso conocido como polimerización el cual da origen a los polímeros plásticos por lo que su uso es básico en la creación de plásticos como el poliestireno.
- Peróxidos inorgánicos: están formados por las combinaciones binarias de oxígeno y los metales. Tienen una estructura de ion peróxido, el cual también es conocido con el nombre de dióxido.
Propiedades
Entre sus propiedades físicas encontramos que el peróxido suele ser un líquido que no tiene color y que tiene además una consistencia similar a la del sirope. Tiene una densidad total de 1.443 g/cm3. Puede llegar a formar cristales cuando se encuentra a una temperatura que tiene la capacidad de fundir, aproximadamente a -0.89°C, y puede también hervir a 151.4°C a condiciones normales de presión.
También puede ser disuelto cuando se enfrenta a líquidos como el alcohol, el agua y el éter sin importar la proporción. Cuando está diluida se conoce con el nombre de agua oxigenada la cual tiene un sabor bastante astringente y áspero.
En cuanto a las propiedades químicas de los peróxidos, éstos no son muy estables. Cuando se encuentran a bajas temperaturas, puede ser descompuesto y si se le añaden partículas de polvo, este proceso puede ser acelerado generando una reacción exotérmica. Todas las disoluciones que son diluidas en peróxido de hidrógeno, pueden ser conservadas muy bien y sustancias como el alcohol, éter y acetanilida funcionan bien como preservadores y hacen también que sean más estables.
Formulación
La fórmula que se utiliza de forma general para representar a los peróxidos es A2(O2)n, en donde A representa al elemento metálico y la n representa el número de oxidación. Es importante mencionar que esta formula no puede ser simplificada al máximo, esto porque en ella siempre deberá de estar presente un número par de átomos que corresponden al oxígeno. Hay algunas reglas importantes en cuanto a la formulación:
- Cuando n es igual a 1, entonces la fórmula del peróxido será A2O2.
- Cuando n es igual a 2, entonces su fórmula deberá de escribirse como A2(O2) Cuando ésta se simplifica entonces quedará como AO2.
- Cuando la n es igual a 3, la fórmula deberá de escribirse como A2(O2)3 y en este caso, no se puede simplificar.
Estructura
La estructura de los peróxidos está formada por un enlace de oxígeno-oxígeno en el cual se encuentra el oxígeno en estado de oxidación, en otras palabras −1. En su estructura además se encuentran compuestos que están formados por el grupo llamado peroxo.
Usos
Uno de los usos de mayor importancia de los peróxidos es la desinfección, esto debido a que cuando liberan oxígeno, éste puede llegar a actuar contra las bacterias eliminándolas. Puede entonces desinfectar superficies con mucha facilidad. En el campo de la medicina es utilizado también con este propósito y por lo general se conoce con el nombre de agua oxigenada.
Es también utilizado como disolvente de pinturas que tienen colores muy brillantes y actúa también como reductor. Otro de sus usos es el de blanquear las fibras de algodón de las telas como la lana, el lino y la seda. Es un poderoso oxidante utilizado en la fabricación de Niacina y es un componente importante de algunos medicamentos y tintes.
Efectos
Cuando el ser humano entra en contacto con los peróxidos, éstos pueden producir varios tipos de efectos secundarios entre los cuales se puede mencionar la irritación en los ojos, en las vías respiratorios y también en la piel. Cuando se ingiere, se pueden producir graves problemas gastrointestinales. Todos los efectos que puede producir dependerán también de la cantidad y la exposición al que la persona sea expuesta.
Dónde se encuentran
Por lo general, pueden llegar a ser encontrados en pequeñas cantidades en el aire, el agua, la lluvia y la nieve, sin embargo, la mayoría de ellos son fabricados por el ser humano pues es una sustancia principalmente manufacturada.
Cómo se forman los peróxidos
Los peróxidos pueden formarse cuando se da la combinación entre un óxido básico y el oxígeno. Algunos de ellos tienen su origen en el momento en el que se da la exposición de una sustancia con el oxígeno presente en el aire, ya sea de manera asistida o sin que exista ningún tipo de catalizador que lo forme. En algunas ocasiones pueden ser formados haciendo reaccionar el agua oxigenada con un alquisulfato.
Importancia
Su principal importancia está relacionada con su uso como antioxidantes y por ello, resultan ser fundamentales en la industria de la farmacéutica, en la alimentaria y en el campo hospitalario. Es también un componente de mucha importancia en la depuración de las aguas residuales, en los envases que se fabrican para almacenar alimentos o sustancias, en la potabilización del agua y en el embotellado de bebidas.
Ejemplos de peróxidos
Algunos ejemplos de peróxidos se mencionan a continuación:
- Peróxido de Potasio K2O2
- Peróxido de Estroncio Sr2(O2)2
- Peróxido de Rubidio Rb2O2
- Peróxido de Bario Ba2(O2)2
- Peróxido de Aluminio Al2(O2)3
- Peróxido de Hidrógeno H2O2
¿Cómo citar este artículo?
Briceño V., Gabriela. (2021). Peróxidos. Recuperado el 23 febrero, 2024, de Euston96: https://www.euston96.com/peroxidos/