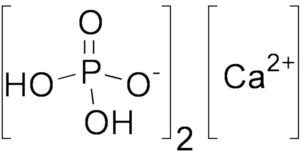
Óxido de calcio
En el campo de la química es común encontrar el nombre óxido de forma continua y es que esta palabra se utiliza para referirse a la mezcla que se da cuando se une un átomo de oxígeno o más con un átomo que pertenece a un elemento diferente. Uno de los óxidos más conocidos en el mundo se conoce con el nombre de óxido de calcio, el cual es generalmente conocido con los nombres de cal viva, cal quemada o calcia.
Temas relacionados
Óxidos básicos, óxido de hierro, óxido de etileno, óxido de cobre, óxido de plata, óxido de sodio, óxido de potasio
¿Qué es el óxido de calcio?
El óxido de calcio mejor conocido con el nombre de cal es un tipo de sustancia alcalina, un compuesto químico que es el resultado del proceso de calcinación de las piedras calizas y que es aplicada principalmente en el campo de la fabricación.
Características del óxido de calcio
Entre las principales características del óxido de calcio se mencionan las siguientes:
- Es producido principalmente producido por medio de la descomposición térmica de piedras calizas o de otros productos que contienen carbonato de calcio.
- El principal productor de óxido de calcio es China, seguida por Estados Unidos.
- Es material no inflamable, sin embargo debe de ser manipulado con precaución.
- Es un tipo de sustancia alcalina.
- Todas sus propiedades dependen del tipo de composición química que tiene y del tratamiento al que se haya sometido el mineral.
- Puede ser encontrado en la naturaleza con facilidad.
Estructura
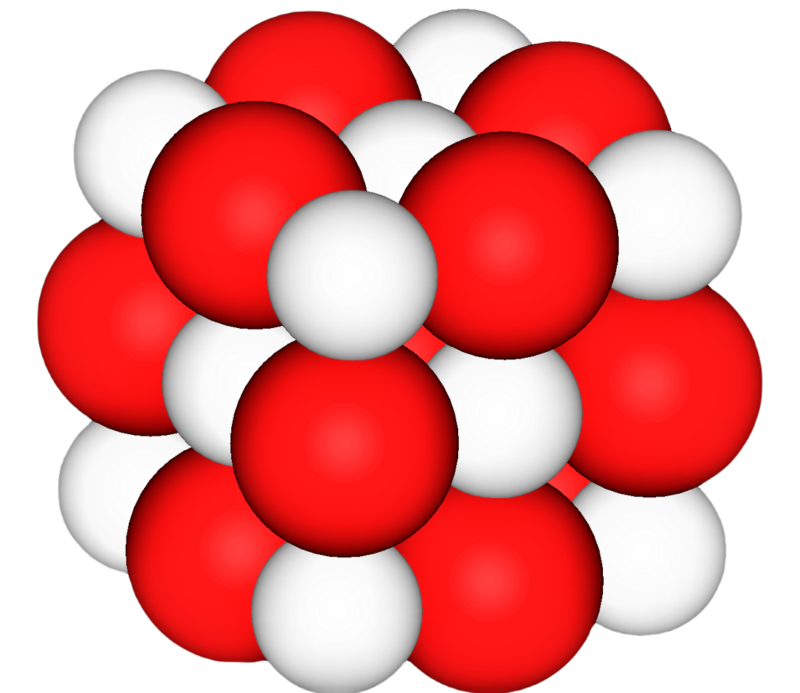
Las moléculas que forman parte del óxido de calcio tienen una estructura química que contiene un catión de calcio (el cual tiene una carga de +2) y un anión de oxígeno (que tiene una carga de -2). Posee además un tipo de estructura cristalina en donde cada uno de los iones de Ca2+ se rodea de seis iones de O2- los cuales se encuentran ocluidos dentro de las cavidades octaédricas que quedan en los espacio de los iones más grandes. La estructura del óxido de calcio se muestra a continuación.
Fórmula
La fórmula química con la cual se define al óxido de calcio es: CaO.
Nomenclatura
Para la nomenclatura del óxido de calcio se utilizan los siguientes sistemas:
- Nomenclatura sistemática: se nombra como monóxido de calcio.
- Nomenclatura stock: se le da el nombre de óxido de calcio.
- Nomenclatura tradicional: su nombre en este tipo de nomenclatura es óxido cálcico.
Propiedades físicas del óxido de calcio
Entre sus principales propiedades físicas que pueden ser encontradas en el óxido de calcio son las siguientes:
- En cuanto a su aspecto físico, el óxido de calcio es de color blanco, es cristalino y no tiene olor.
- Presenta una masa molar de 0774 g/mol.
- Su punto de fusión se ubica en los 572° C.
- Su punto de ebullición es de 850° C.
- Su peso molecular se ubica en los 55,958 g/mol.
- No tiene solubilidad en alcoholes o en solventes de tipo orgánico.
- Los compuestos de óxido no son conductores de la electricidad.
- El óxido de calcio se puede encontrar en forma de gránulos, trozos, polvo, cátodos para pulverización catódica, pastillas y nano polvo.
Propiedades químicas
En cuanto a sus propiedades químicas, las siguientes son propias del óxido de calcio:
- Es un compuesto muy estable por lo que tiene la gran capacidad de soportar altas temperaturas.
- Cuando se encuentra en presencia de agua puede formar lo que se conoce como cal apagada, muerta o hidróxido de calcio.
- La entropía molar estándar correspondiente al óxido de calcio corresponde a 40 julios por mol kelvin.
- Puede producir reacciones exotérmicas, en otras palabras, puede desprender calor, sin embargo, también puede revertir este proceso cuando se deshidrata.
Obtención
El óxido de calcio se puede producir por medio de un proceso que se conoce con el nombre de calcinación. En este proceso, se realiza una descomposición térmica de los reactivos que conforman la piedra caliza o las conchas marinas las cuales tienen altas cantidades de carbonato de calcio. Cuando se eleva la temperatura se vigila también que ésta se mantenga de forma estable por debajo del punto de fusión.
Estas temperaturas oscilan los 1070° C y los 1270° C. Generalmente, el proceso es llevado a cabo dentro de un horno de tipo rotativo y los productos que finalmente se obtienen son la cal quemada y el dióxido de carbono. En el proceso, este dióxido de carbono debe de ser eliminado de forma inmediata para que se siga con el principio de Le-Chatelier, el cual establece que, cuando un sistema equilibrado se somete a cierta condición, éste podrá desplazarse a una nueva posición para poder contrarrestar el efecto que le ocasionó inicialmente un tipo de perturbación para luego poder recuperar el equilibrio.
Usos del óxido de calcio
El óxido de calcio tiene muchos usos, uno de ellos es en el capo de la industria metalúrgica. Es usado en la fabricación del acero cuando se agrega al proceso siderúrgico para que actúe como un agente escorificarte y para que retire las impurezas del metal, de la misma manera actúa en el aluminio.
En el campo de la industria también es muy utilizado. Puede ser usado como un tipo de mortero cuando se mezcla con arena y agua para poder luego formar cal apagada. Forma parte primordial en la producción de vidrio pues éstos utilizan el óxido de silicio y la cal como ingrediente principal. Es también usado en el campo de la medicina y para la fabricación de insecticidas. Es uno de los reactivos más importantes que forman parte de los laboratorios principalmente cuando se necesitan hacer procesos de deshidratación o reacciones de precipitación.
Riesgos
La exposición al óxido de calcio puede provocar varios riesgos y problemas para la salud, principalmente cuando es inhalado. Cuando esto sucede, se pueden presentar irritaciones graves, quemaduras en la piel y en los ojos. El respirar este óxido de forma continua puede provocar una grave irritación en los pulmones, ocasionar tos y falta de aire. Cuando es inhalado de forma continua, puede producir que el líquido se acumule en los pulmones ocasionando un edema pulmonar, lo cual es una emergencia médica.
Además, también puede provocar dolor abdominal, quemaduras por náuseas con perforación del tabique nasal y vómitos. Cuando la cal viva se enfrenta con el agua y reacciona, puede liberar suficiente calor para encender materiales combustibles.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2021). Óxido de calcio. Recuperado el 22 febrero, 2024, de Euston96: https://www.euston96.com/oxido-de-calcio/