Óxido de sodio
En el campo de la química existen varios tipos de compuestos químicos los cuales son sustancias formadas por dos o por más elementos que están dentro de la tabla periódica. Uno de estos compuestos se conoce con el nombre de óxido de sodio.
Temas relacionados
Óxidos básicos, óxido de hierro, óxido de calcio, óxido de etileno, óxido de cobre, óxido de plata, óxido de potasio
¿Qué es el óxido de sodio?
El óxido de sodio es un compuesto químico de tipo inorgánico que pertenece al grupo de los metales alcalinos. Es el anhídrido del hidróxido de sodio pues reacciona con el agua para poder formar dos moles.
Características del óxido de sodio
Entre las principales características del óxido de sodio se mencionan las siguientes:
- Cuando se encuentra en presencia de agua tiene la capacidad de formar hidróxido de sodio.
- Es una fuente de sodio que no es soluble.
- Se considera que es térmicamente estable.
- Cuando se encuentra en su estado más puro puede ser un buen conductor de electricidad.
- Está compuesto de al menos un anión de oxígeno y un catión de tipo metálico.
- Se puede encontrar en pastillas, nano polvo y cátodos.
- Cuando se encuentra en contacto con los ácidos puede llegar a reaccionar de forma violenta y ser inflamable.
- Es un producto altamente corrosivo al exponerse con la piel y los ojos.
- Es un compuesto químico que está formado por dos elementos, el oxígeno y el sodio.
Estructura
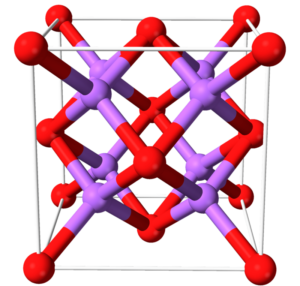
El óxido de sodio tiene una estructura de tipo cristalina la cual corresponde a un tipo cúbico centrado en las caras. El óxido está formado por 1 átomo de oxígeno, el cual tiene dos enlaces iónicos con dos átomos de sodio. Su molécula tiene una estructura cristalina de antifluorita, en la que los átomos de Na se coordinan con 4 átomos de oxígeno, mientras que los átomos de oxígeno se coordinan con 8 átomos de sodio. Gráficamente, su estructura es la siguiente:
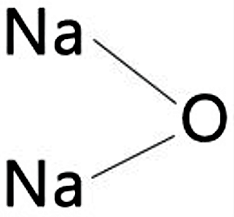
Fórmula
La fórmula química del óxido de sodio es la siguiente: Na2O
Nomenclatura
En cuanto a su nomenclatura, ésta puede darse de tres formas distintas las cuales se mencionan a continuación:
- Nomenclatura stock: óxido de sodio
- Nomenclatura sistemática: monóxido de disodio
- Nomenclatura tradicional: óxido sódico
Propiedades físicas del óxido de sodio
Sus principales propiedades físicas son las siguientes:
- Es un sólido de apariencia cristalina y de color blanco.
- Su peso molecular es de 61.98 g/mol.
- Posee una densidad de 2.27 g/ml.
- Su punto de fusión se encuentra en los 1275° centígrados.
- Su punto de ebullición se da cuando alcanza los 1950° centígrados.
- La densidad del óxido de sodio es de 2,27 g mL-1.
Propiedades químicas
Sus propiedades químicas se mencionan a continuación:
- El óxido de sodio es una sustancia que reacciona con el agua y produce hidróxido de sodio. Esta reacción es altamente exotérmica y violenta y por ello se debe mantener el óxido de sodio alejado del contacto con el agua.
- Cuando logra absorber la humedad se convierte con facilidad en un hidróxido.
- Cuando se combina con el anhídrido carbónico produce carbonato sódico.
Obtención
En cuanto a su obtención es importante mencionar que este compuesto químico no se encuentra de forma libre en la naturaleza por lo que su obtención debe de hacerse por medios químicos. El óxido de sodio se produce principalmente mediante la reacción del hidróxido de sodio con el sodio metálico. También puede llegar a producirse utilizando peróxido de sodio o nitrato de sodio en lugar de hidróxido de sodio. Esta reacción produce hidrógeno como producto secundario:
2 NaOH + 2 Na → 2 Na2O + H2
Otro método es a través de la descomposición térmica del carbonato de sodio hasta 850°C, para producir dióxido de carbono y óxido de sodio:
Na2CO3 → Na2O + CO2
Un tercer método es por medio de la reacción con peróxido de sodio:
Na2O2 + 2 Na → 2 Na2O
Usos del óxido de sodio
El uso principal que se le da al óxido de sodio es en la fabricación de vidrio pues este compuesto químico constituye el 15% de la composición total de este producto. Es muy utilizado en la industria de la cerámica. Es también utilizado como un medio de fundición para poder reducir la temperatura a la que la sílice es fundida pues actúa como un tipo de estabilizador. Al ser un material muy sencillo de trabajar y por su gran capacidad de poder ser reblandecido en varias ocasiones, se puede utilizar en la fabricación de botellas, objetos decorativos de arte y bombillas entre otros.
Además, es un compuesto que puede llegar a ser utilizado en la producción de polímeros adsorbentes y en la fabricación de algunos productos intermedios en la producción de compuestos químicos. A pesar de que no es buen conductor de electricidad en su estado natural, cuando se combina con algunos tipos de óxido puede convertirse en un buen conductor y es usado entonces en el cátodo de las pilas de combustible y en algunos sistemas de generación de oxígeno.
Riesgos
Es importante tener en cuenta que, a pesar de que el óxido de sodio no es inflamable por sí solo, cuando logra entrar en contacto con el agua puede volverse extremadamente peligroso pues se vuelve muy volátil y al mismo tiempo, produce que la combustión de otros tipos de sustancias se eleve de forma considerable. Es además un producto muy corrosivo y cuando entra en contacto con la piel o con los ojos puede llegar a producir quemaduras graves.
Este compuesto químico también puede llegar a producir graves daños en las vías respiratorias cuando es inhalado sin precaución, como por ejemplo, edema pulmonar y si es ingerido, puede dañar todo el sistema digestivo.
En caso de haber estado en contacto con el producto, se recomienda llevar a la persona a un lugar ventilado y en caso de ser necesario, brindar respiración asistida. Si entra en contacto con la piel, la zona deberá de ser bien lavada utilizando abundantes cantidades de agua, la ropa y el calzado deberán de ser removidos de forma inmediata.
Este producto puede llegar a producir una serie de efectos secundarios como inflamación, edema en la laringe, bronquitis, sensación de ardor, sonidos en el pecho, dificultad para respirar de forma adecuada, y neumonitis.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2021). Óxido de sodio. Recuperado el 22 febrero, 2024, de Euston96: https://www.euston96.com/oxido-de-sodio/