Afinidad electrónica
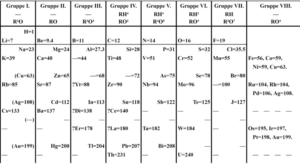
La tabla periódica es un tipo de esquema en el cual es posible encontrar la representación de todos los elementos químicos que existen dependiendo de su número atómico, en ella, es posible encontrar grupos períodos de elementos en los cuales se ubican los elementos que comparten algunas características físicas y químicas. Una de estas características se conoce con el nombre de afinidad electrónica.
¿Qué es la afinidad electrónica?
La afinidad electrónica es una de las propiedades periódicas que tienen los elementos, una medida de la variación energética que posee un átomo cuando se encuentra en estado gaseoso y cuando suma un electrón a su capa de valencia.
En otras palabras, podemos decir que la afinidad electrónica es la capacidad que tiene un átomo determinado para poder aceptar un electrón, es un tipo de energía que se produce cuando un electrón es agregado a un átomo cuando éste se encuentra en estado gaseoso. Es importante mencionar que, aquellos átomos que tienen una carga nuclear con mayor fuerza tendrán una mejor afinidad electrónica.
Propiedades periódicas de la afinidad electrónica
La afinidad electrónica tiene varias propiedades periódicas entre las cuales se mencionan las siguientes:
- Afinidad electrónica negativa propiedad que implica el desprendimiento de la energía y se hace presente en el momento en que los átomos logran adquirir una configuración con mayor estabilidad cuando captan un electrón, por esta razón, la fuerza atractiva es la que predomina en esta propiedad.
- Afinidad electrónica positiva que se basa en la absorción de la energía y se hace presente cuando se debe de proporcionar energía al átomo para que éste tenga la capacidad de poder captar el ion.
- La afinidad electrónica cuenta con valores negativos.
- Tiene la capacidad de aumentar hacia la derecha cuando está en un mismo periodo de la Tabla Periódica, esto porque cuando disminuye su radio atómico, el electrón que se forma puede encontrarse más cerca del núcleo y por esta razón, podrá ser atraído con mayor fuerza.
- También puede aumentar hacia arriba cuando está en el mismo grupo o columna de la Tabla Periódica porque gracias a que el radio del átomo es menor, el nuevo electrón puede ser atraído con mayor fuerza.
- Puede variar si se encuentra en el mismo sentido que la energía de ionización y que la electronegatividad y cuando se encuentra en la parte contraria del radio atómico.
Cómo se determina la afinidad electrónica
Existen varios casos en los cuales la afinidad electrónica puede ser determinada de forma directa por medio del empleo de haces de electrones los cuales chocan contra los átomos cuando están en la fase gaseosa. También puede utilizarse un proceso llamado extrapolación, aunque ésta es una forma menos precisa. Se hace uso de varias escalas representativas para poder determinar la afinidad electrónica pues es un proceso bastante complicado.
Cómo aumenta
La afinidad electrónica de los elementos puede aumentar ascendiendo por grupos y lo hace de izquierda a derecha en la tabla periódica de los elementos. La afinidad puede también aumentar cuando el tamaño que tiene el átomo disminuye, también puede aumentar de abajo hacia arriba, de la misma forma que lo hace la electronegatividad.
En qué se diferencia de la energía de ionización
La principal diferencia que existe entre ellos es que la energía de ionización es aquel tipo de energía que es necesario para poder arrancar un electrón de un elemento que se encuentre en estado gaseoso, esto lo podemos representar de la siguiente manera:
X° (g)+ I ⇒ X⁺ + e⁻
Por otra parte, la afinidad electrónica es un tipo de energía que puede ser extraída o suministrada con el objetivo de poder transformar un átomo neutro en un ion negativo, cuando está en estado gaseoso, es una propiedad que puede medir la tendencia de un átomo y se representa de la siguiente manera:
X°(g)+e⁻⇒X⁻+A
Importancia
Este tipo de propiedad química es importante porque gracias a ella es posible llegar a predecir el carácter oxidante que posee un elemento de la Tabla Periódica porque puede llegar a actuar como oxidante al tener la capacidad de aceptar a los electrones.
Elementos con mayor afinidad electrónica
Los elementos que poseen una mejor afinidad electrónica son los que se encuentran ubicados en la parte de la derecha de la Tabla Periódica, específicamente en el bloque p, y son elementos que además pueden manifestar su carácter no metálico. Las afinidades más altas se encuentran en los elementos que pertenecen al grupo 17 y posteriormente, los que se ubican en el grupo 16.
Otros ejemplos
Algunos ejemplos de afinidades electrónicas se mencionan a continuación:
- Afinidad electrónica del hidrógeno: 72,8 kJ/mol.
- Afinidad electrónica del oxígeno: 141 kJ/mol
- Afinidad electrónica del flúor: 328 kJ/mol
- Afinidad electrónica del silicio: 133,6 kJ/mol
- Afinidad electrónica del yodo: 295,2 kJ/mol
- Afinidad electrónica del litio: 295,2 kJ/mol
- Afinidad electrónica del nitrógeno: 7 kJ/mol
- Afinidad electrónica del carbono: 153,9 kJ/mol
¿Cómo citar este artículo?
Briceño V., Gabriela. (2021). Afinidad electrónica. Recuperado el 23 febrero, 2024, de Euston96: https://www.euston96.com/afinidad-electronica/