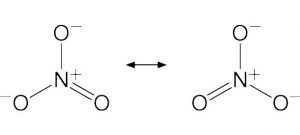
Regla del octeto
En el campo de la química existen muchas reglas que se aplican a los átomos, moléculas y elementos. Una de ellas es la regla del octeto, la cual se basa en la estabilidad que puede llegar a tener un elemento determinado, que en este caso es una capa de valencia que contenga 8 electrones. Esta regla básicamente nos explica la manera en la que todos los elementos químicos pueden llegar a combinarse.

Temas relacionados
Enlaces químicos, enlace covalente, enlace iónico, enlace metálico, enlace peptídico, enlace glucosídico
¿Qué es la regla del octeto?
La regla del octeto dice que los átomos tienen más persistencia cuando tienen ocho electrones y de esta manera, logran alcanzar la máxima estabilidad ya que, cuando dos átomos iguales se enlaza, se organizan mejor.
Enunciado
El enunciado de la regla del octeto nos dice que los elementos siempre persiguen una configuración electrónica que sea estable por medio de la acumulación de ocho elementos los cuales se ubican en las últimas órbitas que se encuentran alrededor del núcleo. Es una regla que establece que, únicamente por medio de la acumulación de ocho electrones se puede conseguir que las diferentes moléculas tengan una buena estabilidad, una que se asemeje a las que tienen los gases nobles.
La regla también establece que los átomos posee cierta tendencia a ganar o a perder electrones en búsqueda de la configuración que les permita tener los ocho electrones y suele presentarse con mayor frecuencia en los elementos que están más cerca de los gases nobles.
Características de la regla del octeto
Entre sus principales características se mencionan las siguientes:
- Establece que los átomos de dos elementos se entrelazan para intentar completar la capa de valencia.
- Para lograr la máxima estabilidad los elementos deberán de ganar o de perder electrones cuando se dan los enlaces químicos.
- Se puede aplicar a la forma en la que los átomos forman sus enlaces.
- Los enlaces dependen siempre de la naturaleza que ellos tengan, así como de las propiedades químicas de las moléculas que resulten de la unión.
- La regla tiene la capacidad de poder predecir la forma en la que muchas sustancias se comportan.
- Pueden ser representados por medio de la Fórmula de Lewis o por el Diagrama de Lewis.
- El octeto electrónico de la regla puede ser alcanzado por medio de enlaces iónicos, covalentes, enlaces metálicos e intermoleculares.
Quién la propuso
La regla del octeto fue propuesta en el año 1917 por Gilbert Newton Lewis, quien notó que cuando los átomos se combinaban entre sí buscaban al mismo tiempo la forma de poder lograr la misma configuración estructural que poseen los gases nobles.
Historia
La historia de la Regla del Octeto proviene del siglo XIX, una época en la que ya se conocía que los compuestos moleculares se formaban por medio de la combinación de los átomos o de las moléculas haciendo que las valencias quedaran de forma ajustada. Fue Alfred Werner quien logró demostrar que la cantidad de átomos que se encontraban en grupos y que tenían un átomo central era por lo general de 4 o de 6, y los que tenían 8 eran poco frecuentes.
Posteriormente, Richard Abegg en el año 1904 amplió el concepto del número de coordinación y le empezó a dar más importancia a la valencia para poder identificar los átomos que funcionaban como receptores de electrones. Tiempo después, Lewis se encargó de establecer la regla del octeto o regla del ocho y con ella creaba una división entre la valencia y los electrones.
Excepciones
No todos los elementos y los compuestos que existen se apegan a la regla del octeto, algunas de estas excepciones son las siguientes:
- Un átomo o ion que posea un electrón de valencia que no esté apareado, lo que se conoce con el nombre de radical libre. Son muy inestables y dimerizan de forma espontánea. Entre ellos se puede mencionar el litio, helio e hidrógeno.
- Los compuestos aromáticos tienen una deslocalización en sus electrones pi, los cuales siguen una regla diferente.
- El aluminio posee seis electrones en lugar de ocho.
- El berilio tampoco sigue la regla porque en su estabilización únicamente se encuentran cuatro electrones.
- El boro porque forma sustancias con tres enlaces simples.
Qué elementos no cumplen la regla del octeto
Existen algunos elementos que no se apegan a la regla del octeto, entre ellos mencionamos:
- Hidrógenos que tiene un único orbital en la capa de valencia y por esta razón, únicamente puede aceptar dos electrones.
- Boro que necesita de seis electrones para poder apegarse a la regla, sin embargo no los contiene.
- Aluminio que puede conseguir la máxima estabilidad únicamente con seis electrones.
- El berilio que completa su última capa de valencia únicamente con cuatro electrones.
Aplicaciones
La regla del octeto puede ser aplicada principalmente en los elementos que se encuentran en el segundo periodo de la Tabla Periódica de los Elementos. Estos únicamente poseen subniveles 2s 2p los cuales pueden llegar a tener ocho electrones en total. Cada vez que alguno de estos elementos forma un tipo de enlace covalente, entonces adquiere la configuración electrónica igual a la de un gas noble.
Ejemplos
Dos ejemplos que pueden explicar la unión química que se presenta en los átomos siguiendo la regla del octeto son los siguientes:
Cloruro de Sodio (NaCl)
Este tipo de compuesto tiene un enlace iónico que se da entre los iones electronegativos del sodio y del cloruro. El cloro tiene un átomo de 7 electrones en su valencia y tiene la capacidad de alcanzar la configuración de octeto cuando gana un electrón.
La parte del sodio tiene una cáscara que se encuentra más externamente únicamente presenta un electrón, si éste se pierde, la cáscara que sigue se convierte en la de valencia, que ya presenta 8 electrones.
El catión que tiene el sodio y el anión que posee el cloruro forman entonces un enlace iónico y la molécula que resulta tiene configuraciones en octetos en los dos átomos.
Óxido de Magnesio (MgO)
La unión que se da entre el oxígeno y el magnesio tiene una naturaleza iónica. El átomo del magnesio puede perder con mucha facilidad dos electrones y de esta manera logra una configuración electrónica estable cuando se une al neón para formar Mg2. El oxígeno por su parte, gana dos electrones para formar así el O2. Estos dos átomos cuentan con configuraciones estables que contienen octetos.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2020). Regla del octeto. Recuperado el 23 febrero, 2024, de Euston96: https://www.euston96.com/regla-del-octeto/