Ácido nítrico
Los ácidos, son un tipo de sustancia que se caracterizan por tener un sabor bastante agrio y por ejercer una acción de tipo corrosiva. Son aquellas sustancias que pueden llegar a donar un protón o un catión de hidrógeno a otro compuesto. Existen varios tipos de ácidos en el campo de la química, uno de ellos se conoce con el nombre de ácido nítrico, un peligroso ácido que puede llegar a producir graves daños en el ser humano.
Temas relacionados
Ácido tranexámico, ácido sulfúrico, ácido fólico, ácido clorhídrico, ácido glutámico, ácido nucleico
¿Qué es el ácido nítrico?
El ácido nítrico es un tipo de mineral ácido y tóxico que tiene una naturaleza muy corrosiva por lo que puede llegar a provocar daños graves al contacto el cual es utilizado principalmente como un tipo de reactivo de laboratorio y para fabricar explosivos.
Características del ácido nítrico
Las características más notables de este tipo de ácido son las siguientes:
- Se obtiene de la mezcla de agua con pentóxido de dinitrógeno.
- Cuando se encuentra presente en una solución en una proporción de más del 86%, entonces pasa a llamarse ácido nítrico fumante.
- Tiene un olor muy fuerte que también es considerado como corrosivo porque puede producir quemaduras en las vías respiratorias.
- Es un ácido que posee un nivel de combustión sumamente elevado y por esta razón, se cataloga como una sustancia inflamable.
- Cuando se encuentra expuesto a temperaturas altas, libera humos o vapores los cuales también son tóxicos y peligrosos.
Historia
El ácido nítrico no es un ácido nuevo pues ya era conocido miles de años atrás por los alquimistas de la Edad Media. Sin embargo, fue hasta el siglo XII cuando se hizo una descripción de la sustancia en el «De Inventioni Veritatis«, el primer manuscrito de la historia que incluía la preparación del ácido, por Glauber el cual había establecido que el ácido nítrico se producía por destilación de una mezcla compuesta por 1 g de vitriolo cyprium (CuSO4-5H2O), 1,5 g de nitrato de potasio KNO3 y 0,25 g de alumbre de potasio (KAl(SO4)2-12H2O).
Cientos de años más tarde, en 1776, Lavoisier demostró que el ácido contenía oxígeno. Cavendish, en 1785, logró producirlo por medio de una descarga eléctrica en aire húmedo, demostrando que contenía nitrógeno y oxígeno. Finalmente, la composición completa fue determinada por Gay-Lussac y Bethollet en el año 1816. Su uso real logró tomar mayor importancia cuando el ácido sulfúrico empezó a utilizarse en el ámbito comercial.
Estructura
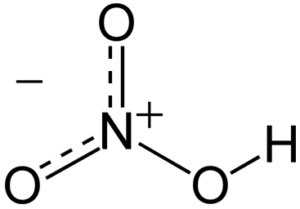
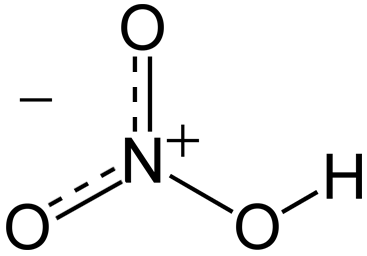
Las moléculas de ácido nítrico contienen 3 átomos de oxígeno, 1 de nitrógeno y 1 de hidrógeno. En las moléculas, uno de los átomos de oxígeno está unido de forma doble al átomo de nitrógeno que está en el centro. Otro átomo de oxígeno está unido de forma simple al átomo de nitrógeno central y también de forma simple a un átomo de hidrógeno. El último átomo de oxígeno de la molécula de ácido nítrico tiene una carga de -1 y está unido al átomo de nitrógeno central. Como el átomo de nitrógeno del centro de la molécula participa en cuatro enlaces covalentes (con 3 átomos de oxígeno), tiene una carga de +1.
Fórmula
El ácido nítrico es un oxoácido nitrogenado cuya fórmula es HNO3 en la cual el átomo de nitrógeno se encuentra unido a un grupo hidroxilo por medio de enlaces equivalentes a los dos átomos de oxígeno restantes.
Nomenclatura
En cuanto a su nomenclatura, el ácido nítrico puede nombrarse utilizando los tres sistemas que existen:
- Nomenclatura sistemática: se conoce como trioxonitrato (V) de hidrógeno.
- Nomenclatura stock: su nombre es ácido trioxonítrico (V).
- Nomenclatura tradicional: esta es la más popular y se conoce como ácido nítrico.
Propiedades físicas del ácido nítrico
Entre las principales propiedades físicas que pueden ser observadas en el ácido nítrico se mencionan las siguientes:
- El ácido nítrico se caracteriza físicamente por se un líquido que tiene una consistencia muy viscosa, no tiene color por lo que es incoloro y además, tampoco tiene olor, por consiguiente es inodoro.
- Tiene un color que oscila entre el amarillo y el marrón y, cuando se encuentra a temperatura ambiente puede despedir humos de color amarillos los cuales tienen un olor muy sofocante.
- En cuanto a su solubilidad en agua se considera como un ácido miscible, lo que quiere decir que puede llegar a mezclarse sin importar la proporción para poder formar una disolución.
- Su punto de ebullición se encuentra en los 83° C.
- Su punto de fusión es de -41,6 ° C.
- Posee una densidad relativa en agua de 1,4.
- Su presión de vapor es de 20° C: 6,4 kPa.
- Tiene una masa molar de 63,012 g/mol.
Propiedades químicas
Sus principales propiedades químicas son:
- Tiene una gran capacidad oxidante.
- Cuando reacciona con compuestos de carburos, polvos metálicos y cianuro, adquiere un gran poder explosivo.
- Cuando se encuentra dentro de una solución acuosa puede disasociarse por completo en un ion NO3 y un protón de tipo hídrico.
- Al estar en contacto con algunos metales como el aluminio y el cromo puede formar una capa de óxido que evita la corrosión de elementos químicos.
- Puede descomponerse cuando se caliente produciendo oxígeno, dióxido de nitrógeno y agua.
- Forma hidratos sólidos como el monohidrato (HNO3-H2O) y el trihidrato (HNO3-3H2O).
Obtención
El ácido nítrico se produce por dos métodos. El primer método utiliza la oxidación, condensación y absorción para producir un ácido nítrico débil. El ácido nítrico débil puede tener concentraciones que oscilan entre el 30% y el 70% de ácido nítrico. El segundo método combina la deshidratación, el blanqueo, la condensación y la absorción para producir un ácido nítrico de alta resistencia a partir de un ácido nítrico débil.
- Producción de ácido nítrico débil: Gran parte del ácido nítrico se fabrica mediante la oxidación catalítica a alta temperatura del amoníaco. Cada paso corresponde a una reacción química distinta. Este proceso suele consistir en tres pasos:
- oxidación del amoníaco
- oxidación del óxido nítrico
- absorción.
- Producción de ácido nítrico de alta resistencia: Se puede obtener un ácido nítrico de alta potencia (con una concentración del 98 al 99 por ciento) concentrando el ácido nítrico débil (con una concentración del 30 al 70 por ciento) mediante destilación El ácido nítrico débil no puede concentrarse mediante una simple destilación fraccionada por lo que ésta debe realizarse en presencia de un agente deshidratante, en este caso, el ácido sulfúrico concentrado es el ideal.
El proceso de concentración de ácido nítrico consiste en alimentar con ácido sulfúrico fuerte y con ácido nítrico la parte superior de una columna de deshidratación a una presión aproximadamente atmosférica.
El ácido nítrico concentrado sale de la parte superior de la columna en forma de vapor al 99%, conteniendo una pequeña cantidad de NO2 y oxígeno resultante de la disociación del ácido nítrico. El vapor de ácido concentrado sale de la columna y va a un blanqueador y a un sistema de condensación para realizar la condensación del ácido nítrico fuerte y la separación del oxígeno.
Usos del ácido nítrico
El ácido nítrico es utilizado principalmente como un reactivo en los laboratorios, para la fabricación de varios tipos de explosivos como el trinitrotolueno o TNT y el ciclotrimetilenetrinitramina o RDX. Es también usado para crear algunos tipos de fertilizantes, como por ejemplo, el nitrato de amonio. Algunos de sus usos adicionales se dan en el campo de la metalurgia y en la refinación puesto que es un ácido que puede reacción con la mayor parte de los metales.
Beneficios
Su principal beneficio se da dentro de la industria agroalimentaria pues gracias a este tipo de óxido se pueden fabricar diferentes tipos de fertilizantes que ayudan a fortalecer las raíces de las plantas. Es utilizado en muy pequeñas cantidades en la fabricación de algunos tipos de muebles y es como un producto que ayuda a destaquear tuberías.
Riesgos
Son muchos los riesgos que pueden presentarse cuando se está expuesto al ácido nítrico. Si el contacto es con los ojos, se pueden producir quemaduras severas además de dolor, enrojecimiento y mala visión. Cuando toca la piel, es muy irritante y corrosivo por lo que también producirá quemaduras y lesiones severas. Si el ácido nítrico se inhala, los humos y los gases irritan todo el tracto respiratorio superior produciendo graves quemaduras en la garganta, dificultad para respirar y edema pulmonar en los casos más graves.
Si se ingiere, la quemaduras serán mortales pues las membranas y las mucosas de boca, esófago y estómago serán quemados. La sobre exposición a este ácido puede provocar la muerte.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2021). Ácido nítrico. Recuperado el 22 febrero, 2024, de Euston96: https://www.euston96.com/acido-nitrico/