Electrólisis
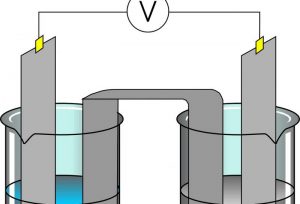
La electrólisis es un proceso por medio del cual se pueden separar los elementos que tiene un compuesto utilizando la electricidad. Algunas sustancias como las sales y algunos óxidos metálicos son buenos conductores de electricidad y sufren descomposición cuando experimentan el paso de una corriente eléctrica, estas sustancias son llamadas electrolitos, y a este fenómeno se le conoce con el nombre de electrólisis. Es un proceso de oxidación y reducción que implican un aumento en la energía libre del sistema que requiere una fuerza externa de energía. Las reacciones que se dan en el proceso de electrólisis se determinan por leyes de energía.
¿Qué es la electrólisis?
La electrólisis es el proceso por medio del cual la corriente eléctrica pasa a través de una sustancia para efectuar un cambio químico en ella produciendo separación. El cambio químico es aquel en que la sustancia pierde o gana un electrón y puede ser oxidación o reducción.
Historia de la electrólisis
Fue el británico William Whewell, un gran científico, filósofo y autor de numerosos textos, que junto a Michael Faraday en el año de 1834 inventó el término «electrólisis» para definir el proceso de descomposición química de la corriente galvánica. A inicio del siglo XIX, esta palabra fue introducida rápidamente en los campos de química, mineralogía y metalurgia por medio de una serie de experimentos en los cuales, al introducir electricidad en una sustancia, podían surgir diferentes tipos de descomposiciones, permitiendo conocer y entender los elementos de dicha sustancia. En 1850 y 1860 se hicieron experimentos médicos en Norteamérica y Europa utilizando la electrólisis.
Para qué sirve
Electro metalurgia: muchos de los metales que son altamente reactivos, como los que pertenecen al grupo 1 y 2, se extraen de sus matrices por electrólisis de sus minerales fundidos. Metales como el sodio y el magnesio, son fabricados por la electrólisis de sus cloruros fundidos. El aluminio puro se obtiene a partir de una solución de su óxido en criolita fundida.Se utiliza en la fabricación de algunas sustancias importantes como hidrógeno, cloro, hidróxido de sodio y oxígeno. Se utiliza en la producción de aluminio, litio, sodio, ácido clorhídrico, cloruro de potasio, hidrógeno potasio, y magnesio. Es utilizado en soluciones salinas para la producción de cloro el cual se utiliza en el agua de las piscinas. Por medio de la anodización de la electrólisis se puede proteger metales en estado de corrosión.
Cómo funciona
La conductividad eléctrica de las sustancias es un desplazamiento de la carga eléctrica a través de ellas. Este desplazamiento que se en las cargas puede producirse de dos formas: por medio de un flujo de electrones, como suele pasar en los metales, y a los que se les da el nombre de conductores de primera especie; y por medio de movimiento de los iones positivos y negativos, por medio de una disolución o un compuesto iónico fluido. Esta forma de conductividad se conoce como conductividad iónica, también llamada, electrolítica, tratándose de la conductividad propia de los electrolitos que son conductores de segunda especie. Es entonces, un proceso en cual el paso de la corriente eléctrica por medio de una disolución o un electrolito fundido da como resultado una reacción de oxidación – reducción, mejor conocida como redox.
Proceso
Podemos entender el proceso observando un ejemplo que involucra la purificación de un metal de cobre. Este proceso requerirá un ánodo, un electrodo con carga positiva y un cátodo, un electrodo con carga negativa. En este caso, un metal de cobre impuro es el ánodo, mientras que el metal de cobre puro es el cátodo.
Aplicaciones
Mediante el proceso de electrólisis se pueden descomponer diferentes compuestos en sus elementos como por ejemplo el hidrógeno. Es usado también para purificar un metal como por ejemplo cobre. Es utilizada también para recubrir algunos metales con otro metal con el fin de embellecerlo o evitar la corrosión. Los metales que habitualmente se depositan son el oro, la plata, el cromo, el estaño y a este proceso se le denomina galvanotecnia.
Electrólisis del agua
La electrólisis del agua necesita para funcionar que el agua no esté en su estado puro, debe de tener algunas concentraciones de sales y algunos minerales; y se debe de utilizar corriente directa durante el proceso. Permite obtener elementos químicos, tales como el hidrógeno y el oxígeno. Se puede aplicar a agua dulce o salada, obteniendo diferentes resultados. Del agua salada obtendremos cloro e hidrógeno en estado gaseoso.
Electrólisis del cloruro de sodio
Los iones cloruro pierden sus electrones cuando se transforman en átomos de cloro, los cuales a su vez forman las moléculas de cloro gaseoso. La reacción anódica que sucede en este caso es de oxidación. Estas reacciones de electrodo se llaman semirreacciones, y la reacción global de la electrólisis del cloruro de sodio es: 2Na+ + 2Cl- → 2Na ° + Cl2.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Electrólisis. Recuperado el 22 febrero, 2024, de Euston96: https://www.euston96.com/electrolisis/