Ley de Lavoisier
Con el desarrollo de ideas más precisas sobre los elementos, los compuestos y mezclas, los científicos comenzaron a investigar cómo y por qué las sustancias reaccionaban entre ellas. El químico francés A. Lavoisier fue quien sentó las bases de la investigación científica de la materia al describir que las sustancias reaccionan siguiendo ciertas leyes. Estas leyes se llaman leyes de combinación química.

Temas relacionados
Ley de la conservación de la materia, ley de las proporciones definidas, ley de las proporciones múltiples
¿Qué es la ley de Lavoisier?
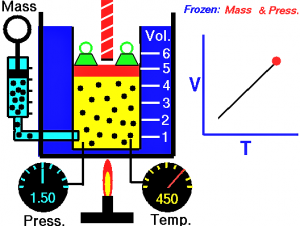
La ley de Lavoisier es una ley que nos dice que en todas las reacciones químicas que se realizan, la masa de los componentes de la reacción se conserva, nunca se destruye ni se crea nueva materia, que lo único que sucede es que se reorganiza.
En qué consiste la ley de Lavoisier
La ley de Lavoisier consiste en un enunciado que nos dice que en toda reacción química, la masa se conserva, en otras palabras nos dice que la masa total de los reactivos es igual a la masa total que tienen los productos. En resumen nos explica que la materia no se crea ni se destruye durante un proceso químico sino que únicamente se reorganiza.
La ley es uno de los pilares del nacimiento de la ecuación química junto con la nomenclatura moderna que tienen los compuestos químicos. Recibe su nombre de Antoine Laurent Lavoisier, un químico francés cuyo trabajo fue tan importante que aún perdura como base de la química moderna.
Historia
Lavoisier es considerado como el precursor de la química moderna, y fue quien realizó uno de los descubrimientos más importantes de esta ciencia, la Ley de la conservación de la masa. Durante el siglo XVIII no se daba mucha atención al aspecto cuantitativo de la ciencia. Se mezclaban sustancias, observaban y describían sus polvos y sus gases, pero no se medían. Luego apareció Lavoisier quien pensó que la medición era la parte más importante y que ésta era la base para los experimentos químicos.
Lavoisier nació en París, en 1743, tuvo una excelente educación, fue licenciado en derecho, luego estudió Astronomía, Historia Natural y Química. Trabajó durante años en ciencia y tecnología y descubrió el secreto de aquello que los alquimistas llamaban la «transformación del agua en tierra» y que para ellos era una clara prueba de la trasmutación de elementos.
Estableció que el aire es una mezcla de un 27 % de oxígeno y un 79 % de nitrógeno. Precisó la noción de sustancia pura, adoptando el concepto de “elemento” de Boyle. Usó el Principio de Conservación de la Materia y realizó las primeras medidas calorimétricas. Demostró la presencia de oxígeno en bases y ácidos y colaboró en la elaboración de una nueva nomenclatura química, muy similar a la actual, en la que los nombres de las sustancias reflejan su composición química.
Quién la propuso
La ley de Lavoisier fue propuesta por Antoine-Laurent de Lavoisier (1743-1794) quien fue un reconocida economista, químico y biólogo francés, una importante figura en la revolución química del siglo XVIII.
Enunciado de la ley de Lavoisier
El enunciado de la ley de Lavoisier puede ser dada en tres diferentes maneras que son:
- La materia ni se crea ni se destruye, sólo se transforma.
- En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
- En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Fórmula
La fórmula de la ley de Lavoisier nos dice que la masa de los reactivos = a la masa de los productos.
Experimentos
Añadir 50 ml de vinagre en un Erlenmeyer y pesar en la balanza. Luego añadir dos cucharaditas de bicarbonato sódico en un vaso para anotar su peso con exactitud y, posteriormente, añadir el bicarbonato sobre el vinagre. Observar durante la reacción lo que ocurre y si el Erlenmeyer aumenta o disminuye su temperatura. Cuando la reacción acaba se pesa el Erlenmeyer para obtener el peso de los productos.
Aplicaciones
Algunas de las aplicaciones más importantes de la ley son las siguientes:
- Conocer la masa de reactivos que se necesitan para obtener una cantidad determinada de producto en una reacción química
- El realizar cálculos estequiométricos.
- Pilar de las reacciones químicas
- La industria farmacéutica se basa en ella
Importancia de la ley de Lavoisier
Gracias a su ley se sabe hoy en día que la teoría del flogisto sobre la combustión era falsa, que la materia puede llegar a cambiar y crear nuevas sustancias, pero que no tiene la capacidad de surgir de la nada o desaparecer. Gracias a su ley de la conservación de la materia, se crearon las bases de la nomenclatura y química actual, y el medir los compuestos pasó a ser de vital importancia para la investigación en el área de la química.
Ejemplos
Algunas situaciones cotidianas donde podemos observar la ley de Lavoisier son las siguientes:
- En las diferentes reacciones químicas de combustión como por ejemplo al quemar un producto determinado y que quede un poco de la masa en cenizas y los demás se transforma en gases.
- La ebullición que se genera cuando se calienta por ejemplo 100 gramos de agua en estado líquido que cuando se caliente e hierve deja como resultado 100 gramos de vapor al pasar mucho tiempo.
- Cuando se prepara una limonada en la cual se colocan 100 gramos de azúcar 500 gramos de agua y 50 gramos de jugo de limón esto no da un total de 650 gramos de la mezcla total.
- Cuando se le pone a un automóvil 40 Kilogramos de combustible, después de haber consumido todo el combustible, el auto pesará 40 Kilogramos menos, pero en el ambiente hay 0 Kilogramos más de gases que han surgido producto de la combustión.
- En el proceso digestivo, cuando una persona se alimenta, el organismo absorbe lo que necesita para transformarlo en energía y expulsa lo que no necesita en forma de orina y heces.
¿Cómo citar este artículo?
Briceño V., Gabriela. (2018). Ley de Lavoisier. Recuperado el 24 febrero, 2024, de Euston96: https://www.euston96.com/ley-de-lavoisier/