Características del óxido de plata
Las principales características que pueden ser encontradas en el óxido de plata son las siguientes:
- Es un tipo de compuesto químico que suele tener un color negro o un color café muy oscuro.
- Puede ser producido con facilidad para su uso comercial.
- Es un tipo de óxido binario.
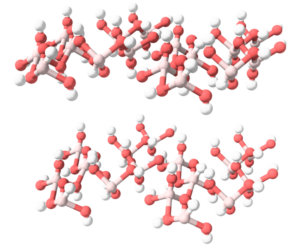
- Tiene forma de polímero tridimensional.
- Se une por medio de enlaces covalentes iónicos.
- Está formado básicamente por dos elementos, la plata, la cual tiene una valencia 1 y el oxígeno que tienen una valencia 2.
- Trabaja principalmente con valencia +1 lo que hace que, cuando pierde un electrón en su configuración electrónica, se vuelva muy estable.
Estructura
En cuanto a su estructura química, el óxido de plata, al ser de tipo binario, tiene un estructura de tipo tridimensional el cual se une por medio de enlaces covalentes dentro de su estructura. Los iones de AG+ y 02- se encuentran en este tipo de enlace en una proporción de 2:1 y están expuestos además a un tipo de atracción electrostática. Además, se ha logrado identificar que los iones de Ag+ posee geometrías planas cuadradas.
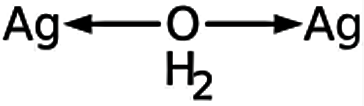
Fórmula
La fórmula química del óxido de plata es Ag2O.
Nomenclatura
Con respecto a su nomenclatura, ésta se realiza de la siguiente manera:
- Nomenclatura sistemática: monóxido de diplata
- Nomenclatura stock: óxido de plata
- Nomenclatura tradicional: óxido argéntico
En cuanto a su nomenclatura, es importante sabe que, desde el momento en el que se empezaron a introducir los iones Ag2+ y Ag3+ al término, la nomenclatura cambió. Considerando que el Ag2+ es muy inestable lo que lo hace ser casi inexistente, se toma en cuenta aquellos iones que tienen valencias +1 y +3, en otras palabras Ag(I) y Ag(III).
En el caso de las valencias I y III y por ser el Ag(I) el que tiene menor valencia, se le debe de nombrar adicionando el sufijo -oso al nombre argentum. Entonces el Ag2O se conoce como óxido argentoso (monóxido de diplata). El Ag(III) tiene la valencia mayor y por esto, se le adiciona el sufijo -ico, entones, el AG2O3 se conoce como óxido argéntico.
Propiedades físicas del óxido de plata
El óxido de plata tiene varias propiedades físicas las cuales son:
- Tiene la capacidad de formarse por medio de un proceso que es considerado termodinámicamente reversible.
- El óxido de plata posee una densidad que alcanza los 7140 Kg/m3.
- Su masa molar es de 231,735 g/mol.
- Tiene un punto de fusión cuando está expuesto a temperaturas de 277º C.
- Su solubilidad es prácticamente nula debido a que las esferas que forman parte de su estructura casi no difieren en el tamaño y por esta razón, únicamente moléculas diminutas pueden ingresar al interior de la red.
Propiedades químicas
Las siguientes son las propiedades que posee el óxido de plata:
- Tiene una configuración electrónica de [Kr]4d8.
- Son compuestos que contienen al menos un anión de oxígeno y un catión metálico.
- Suelen ser insolubles en soluciones acuosas (agua) y además son extremadamente estables.
- Los compuestos de óxidos metálicos son basihidruros y, por consiguiente, tienen la capacidad de reaccionar con los ácidos y con los agentes reductores fuertes en las reacciones redox.
- Reacciona peligrosamente con el amoníaco. Fundir el óxido de plata con sulfuros metálicos, selenio, azufre o fósforo puede provocar la ignición. Es además incompatible con hidracinas, aminas, azufre, sulfuros metálicos y monóxido de carbono.
Obtención
La forma de obtener el óxido de plata es por medio de la combinación de soluciones acuosas de nitrato de plata con un hidróxido alcalino.
Usos del óxido de plata
Uno de los principales usos del óxido de plata es disolverlo en amoníaco para poder así producir el reactivo de Tollens, el cual, es un reactivo que funciona a la perfección para realizar diferentes tipos de análisis cualitativos en los laboratorios de química orgánica. Cuando se mezcla con zinc metálico puede dar forma a las baterías primarias de zinc-óxido de plata, y este es el uso más común del óxido de plata pues se encuentra en hogares y empresas.
Es también utilizado como un tipo de purificador de gases pues se encarga de absorber el dióxido de carbono, luego al calentarse, tiene la capacidad de liberar los gases que logró atrapar en el proceso y puede ser utilizado de nuevo. Gracias a las propiedades antimicrobianas que posee la plata, uno de sus componentes, este óxido es muy utilizado en diferentes estudios de bioanálisis y para purificar los suelos.
Funciona como un tipo de agente antioxidante que tiene la capacidad de poder oxidar los aldehídos y es usado también como un componente en la reacción de Hofmann participando además como un tipo de reactivo o de catalizador en varias reacciones de tipo orgánicas. En las aleaciones para soldadura, en contactos eléctricos e incluso en aleaciones para fabricar piezas dentales, el óxido de plata también puede ser utilizado.
Riesgos
El óxido de plata es un oxidante fuerte y por esta razón puede llegar a ocasionar varios riesgos a la salud. Cuando entra en contacto con los ojos puede llegar a producir una irritación importante así como quemaduras en los globos oculares. En la piel, puede también provocar irritaciones y quemaduras. Si este óxido es ingerido, puede volverse potencialmente peligroso, provocar graves daños en todo el sistema gastrointestinal, vómitos, náuseas y quemaduras.
Cuando se inhala, el sistema respiratorio se ve muy afectado provocando ardor en la nariz, en la garganta, tos continua, dificultades para respirar y en casos más graves, edema pulmonar. La inhalación crónica de este producto puede desencadenar una neumoconiosis.