Anhídridos
Aunque para muchos la química es simplemente una materia difícil, la cual la gran mayoría solo cursa cuando está en la preparatoria, esta se encuentra dentro de nuestra vida diaria de muchas maneras como lo es el caso de los anhídridos.
¿Qué son los anhídridos?
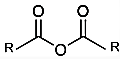
En química podemos definir los anhídridos como un compuestos químicos de tipo binario que surgen al juntar un No Metal con Oxígeno, también son llamados como Óxidos No Metálicos u Óxidos Ácidos, cuya fórmula general es (RCO)2º. Y son productos de la condensación de 2 moléculas de ácidos carboxílicos
Definición
Buscando su origen etimológico la palabra anhídrido su origen viene del griego es una palabra que se formó con la suma de varios complementos: Tiene el prefijo ‘An’ que se refiere al equivalente “SIN”, luego posee el sustantivo ‘Hydros’ que es sinónimo de AGUA, y tiene sufijo ‘ido’ que podría significar “QUE TIENE ASPECTO” y dándole sentido a la palabra al español se define como “Tiene aspecto de no tener agua.”
Tipos de anhídridos
Anhídridos Simétricos ó Simples: Que es cuando ocurre la condensación y los ácidos que lo forman son iguales. Se nombran reemplazando la palabra ácido por Anhídrido.
Anhídridos Asimétricos ó Mixtos: Aparecen cuando la condensación que ocurre es con 2 ácidos distintos, y éstos anhídridos se nombran ordenando alfabéticamente los ácidos
Anhídridos Cíclicos: Se forman cuando la condensación o ciclación se da a partir de un diácido, se nombran cambiando la palabra Ácido y se coloca Anhídrido y con la terminación “oico”. Ejemplo: Anhídrido Benzoico
Características de los anhídridos
Entre sus características está:
- La fórmula de los anhídridos es del tipo X2On (donde X es un elemento no metálico y O es oxígeno) Ejemplos: SeO, So3, CO2
- Poseen la característica de ser especialmente reactivos.
- Se pueden manejar en muchas áreas, lo habitual, donde son más vistos y usados es en la fabricación de medicamentos. Como por ejemplo en el ámbito medico existe uno muy usado llamado Ácido Acetilsalicílico un fármaco que es muy utilizado
- Como ya se ha mencionado vienen a ser fruto de la deshidratación de dos moléculas pero también existen casos donde pudiese ser una, en el caso intramolecular, de ácido carboxílico.
- También son llamados anhídridos carboxílicos.
Propiedades físicas y químicas
Físicas
No poseen brillo y tienen diversos colores, la mayoría son sustancias que forman soluciones ácidas, en sus capas externas encontramos al menos 4 electrones aunque pueden ser más, en solución acuosa forman Aniones u Oxianiones, no sirven para ser conductores de electricidad ni de calor, los que son sólidos generalmente son quebradizos, duros y otros blandos.
Químicas
Una vez se junta agua con los dos ácidos que lo habían transformado en anhídrido desaparecen cuando existe un incremento en la temperatura. Ese paso es llamado Hidrólisis, cuando reaccionan con alcoholes y fenoles se forman ésteres (Proceso de Alcohólisis) y cuando reaccionan con amoníaco surgen entonces las famosas amidas (Proceso de Amonólisis).
Obtención
Los anhídridos son compuestos que se obtienen en bajos puntos de fusión al momento de hacerlos reaccionar con el no metal y el oxígeno, muchas de las sustancias que se obtienen con la unión de ambos elementos son sustancias de forma gaseosa.
Cuando se obtienen óxidos ácidos se reconocen es porque cambian de color y es un indicador de lo ácido, ejemplo: el papel tornasol azul, al ser éste papel expuesto a las disoluciones ácidas se tornan de un color rosado por el contacto con éstas.
Usos y aplicaciones
Los anhídridos u óxidos no metálicos tienen múltiples usos y aplicaciones en la vida cotidiana solo que se utilizan con nombres vulgares que constantemente están en nuestro entorno pero por no saber sus nombres científicos no llegamos a reconocerlos por ejemplo:
- El anhídrido Carbónico, que es mayormente conocido como Dióxido de Carbono el CO2, es un gas que tiene un montón de propiedades que lo hacen perfecto para extinción de cualquier incendio.
- El anhídrido Sulfuroso, se utiliza como un conservante y antioxidante el cual se halla en los frutos secos que nos gusta consumir en mermeladas, jugos artificiales y en el vino. SO2
- El anhídrido Silícico SiO2, se manipula y utiliza como un abrasivo para la realización de discos, la fabricación de lijas y hasta bloques.
- El anhídrido Bórico B2O3, se utiliza en la medicina, para crear productos insecticidas, en la energía nuclear se encuentra, para conservación, en la pirotecnia, entre otros.
- El anhídrido Brómico Br2O5, los bromuros intervienen evidentemente en la medicina como sedantes, específicamente el bromuro de plata se maneja como dispositivo fundamental para las placas fotográficas que te crean cuando te fracturas un hueso.
- El anhídrido Etanoico o Acético, está relacionado con la fabricación de acetato de celulosa, de resinas, también en la síntesis de aspirinas, entre otros.
Formulación de los anhídridos
Se enuncian de la siguiente manera:
Se ubica el símbolo del elemento No Metálico junto a la valencia del oxígeno el signo + y al lado el Oxígeno con la valencia del elemento No metálico.
Nomenclaturas de los anhídridos
Nomenclatura tradicional: En lo anhídridos se aplica de la siguiente forma, se coloca de primer lugar la palabra Anhídrido y después el nombre del elemento No Metálico y se requiere saber y tener en claro la valencia del no metal según estos criterios
- Una valencia Terminación “ico”
- Dos valencias Terminación “oso” menor valencia y mayor “ico”
- Tres valencias Terminación “Hipo..oso” (en la 1), “oso” (en la 2), “ico” (en la 3).
- Cuatro valencias Terminación “Per..ico” (en la 4)
Nomenclatura stock
Se coloca de primero la palabra Óxido seguido de el elemento No Metálico y por último el número de valencia del no metal en número romanos y entre paréntesis. Ejemplo: Óxido de Carbono (IV)
Nomenclatura sistemática
Consiste en colocarle un prefijo a la expresión Óxido pero dependiendo del número de átomos de cada elemento y después se coloca el elemento No Metálico precedido de la valencia del no metal.
Según los átomos son:
- MONO.
- DI.
- TRI.
- TETRA.
- PENTA.
- HEXA.
- HEPTA.
Ejemplo: P205 Pentaóxido de Difósforo; Cl2O Monóxido de Dicloro
¿Cómo citar este artículo?
Calderón, Grecia. (2019). Anhídridos. Recuperado el 24 febrero, 2024, de Euston96: https://www.euston96.com/anhidridos/