Ley de Hess
Para poder comprender esta ley es necesario también hablar de termodinámica la cual es un área de la física que tienen como función primordial el estudio de la relación que existe entre el trabajo y el calor, los cuales son los medios con los que un cuerpo o un sistema puede transformar la energía. Entonces, la ley de Hess se utiliza para comprobar de forma indirecta el calor que se produce en una reacción y el precursor de la misma.
¿Qué es la ley de Hess?
La ley de Hess nos dice que la energía que proviene del calor, la cual es absorbida o desprendida por medio de una reacción química dependerá únicamente de las sustancias reaccionantes y de los productos.
En qué consiste la ley de Hess
Esta ley es utilizada principalmente para poder realizar una comprobación de forma indirecta del calor de reacción y nos dice que, para una determinada reacción, la variación que se da en la entalpía siempre dependerá del estado inicial de los reactivos y del estado final que tengan los productos, y este proceso se produce en diferentes etapas. La ley también explica que, si durante un proceso de reactivos éstos reaccionan para producir productos, el calor que es liberado o que es absorbido es totalmente independiente de si la reacción tuviera lugar en uno o en varios periodos. En otras palabras más fáciles de entender, explica que el calor que se produce en la reacción únicamente necesitará de los reactivos y de los productos.
Quién la propuso
La ley de Hess fue propuesta en el año 1840 por el doctor y químico de nacionalidad rusa Germain Hess quien ayudó a crear y formular los principios iniciales relacionados con la termoquímica los cuales han sido una de las contribuciones más importantes de la química.
Historia
La ley fue propuesta por Germain Henri Hess, quien nació en agosto del año 1802. Sin tener ningún tipo de marco teórico o material de apoyo, Hess logró establecer esta ley la cual permite medir de forma directa la reacción del calor. Fue un científico que fundamentó su trabajo en aspectos teóricos del campo de la química y conforme su investigación avanzaba empezó a estudiar las cantidades de calor que eran producidas por las diferentes reacciones químicas. Hizo una gran cantidad de experimentos químicos demostrando de esta manera que el calor podía ser producido de la misma manera mientras que las reacciones se producían de forma indirecta por etapas y por medio de intermediarios.
Enunciado de la ley de Hess
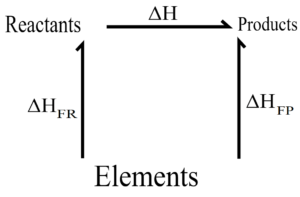
El enunciado principal de la ley de Hess nos dice que: la variación de la entalpía que se da en una reacción química siempre será la misma si ésta se origina en una única etapa o en varias etapas. En este enunciado es importante recordar que la entalpía se refiere a la cantidad de calor que puede ser liberado por un sistema que es considerado como termodinámico o a la cantidad de calor que es absorbida del entorno que rodea a este sistema.
Formula
Es importante entender que la ley de Hess es la suma de todos los cambios de entalpías que se dan dentro de una determinada reacción y que además establece que el cambio de entalpía total es el mismo sin importar si éste se da un único paso o si requiere de múltiples de ellos para la reacción. La fórmula que se utiliza para aplicar la ley es la siguiente:
Este tipo de ecuación utilizado para aplicar la ley de Hess puede ser aplicado en una reacción que sucede durante una única etapa o también puede ser aplicado a la suma de varias reacciones intermedias.
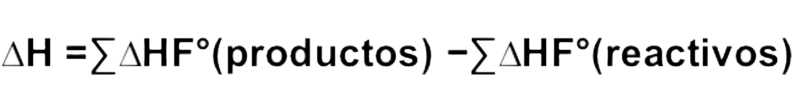
Explicación
La ley de Hess o la ley de la suma de calor constante se utiliza principalmente para poder calcular la entalpía estándar de reacción por medio de diferentes pasos. Para entenderla adecuadamente, se debe recordar que la entalpía es una función del estado de un sistema y por esta razón es independiente del camino que se toma para poder alcanzar el estado final en el que se encuentra a partir del estado inicial que tenía.
De acuerdo a esta ley, cuando se da una determinada reacción que tiene varios pasos, la entalpía de la reacción estándar tendrá varios pasos por seguir y es además totalmente independiente del camino o de la cantidad de pasos que se ha dado, por el contrario, es el resultado de la suma de las entalpías estándares que se produjeron en las reacciones intermedias que participaron a una misma temperatura.
Aplicaciones de la ley de Hess
La principal aplicación de la ley de Hess es su utilización para poder deducir el cambio que se presenta en la entalpía durante una determinada reacción como un tipo de paso intermedio desde una partícula que es más compleja. Con ella se puede entender y estudiar las entalpías de formación de compuestos o de intermediarios que son considerados como inestables, principalmente en la rama de la química orgánica.
Es también aplicada en las transiciones de fases como las que se realizan durante los estudios de sólidos cristalinos y en las entalpías de transiciones de tipo alotrópica, como por ejemplo en materiales como el diamante y el grafito. Es una de las mejores técnicas para poder determinar la cantidad de energía reticular que posee un sólido e incluso para estudiar las afinidades electrónicas que posee un átomo.
Importancia
Esta ley es importante porque ayuda a poder realizar análisis sobre las bases de la termodinámica como un tipo de solución a varios problemas relacionados con la transferencia de calor en los procesos diarios.
Ejemplos
Un ejemplo de la ley de Hess es el siguiente:
La reacción de síntesis del acetileno, C2H2, es:
2 C(grafito) + H2(g) = C2H2(g)
Calcula su variación de entalpía a partir de las siguientes ecuaciones:
- C(grafito) + O2(g) = CO2(g) ; DHa= -393,5 kJ
- H2(g) + 1/2 O2(g) = H2O(l); DHb=-285,8 kJ
- 2 C2H2(g) + 5 O2(g) = 4 CO2(g) + 2 H2O(l); DHc=-2598,8 kJ
Es necesario lograr hacer una ecuación que tenga sólo C y H2 primeramente y C2H2 en segundo lugar, y por eso se debe de eliminar el O2, CO2 y H2O. Esta ecuación se puede obtener a partir del algoritmo: 2·a + b – 1/2·c
Llevamos a cabo las operaciones indicadas y se suman las ecuaciones intermedias y sus entalpías:
- 2 C(grafito) + 2 O2(g) = 2 CO2(g)
- H2(g) + 1/2 O2(g) = H2O(l)
- 2 CO2(g) + H2O(l) = C2H2(g) + 5/2 O2(g)
- 2 C(grafito) + H2(g) = C2H2(g)
La variación de entalpía de la reacción es:
DH = 2·DHa + DHb – 1/2·DHc = 226,6 kJ
¿Cómo citar este artículo?
Briceño V., Gabriela. (2020). Ley de Hess. Recuperado el 23 febrero, 2024, de Euston96: https://www.euston96.com/ley-de-hess/