Características del enlace metálico
Las principales características de este tipo de enlace son las siguientes:
- Son no direccionales, esto quiere decir que tienen atracción electrostática.
- Tienen gran fuerza de unión metálica la cual depende de la carga que tengan los cationes.
- Poseen un brillo metálico como resultado de la interacción que se da entre los electrones del metal con las diferentes longitudes de la onda.
- Tienen conducción de energía eléctrica.
- Tienen conducción de energía térmica cuando se calientan los electrones que lograr adquirir entonces una enorme cantidad de energía cinética y pueden desplazarse a regiones más frías.
- Poseen características de disipación de energía cuando sucede el choque y de vibración de cationes.
Cómo se forma el enlace metálico
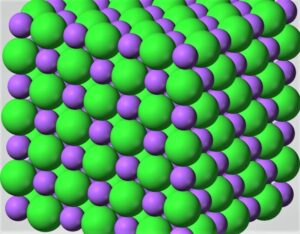
El enlace metálico se produce cuando se da la combinación de metales entre sí. Se sabe que los metales necesitan ceder algunos de sus electrones para poder alcanzar la configuración de gas noble, los metales entonces pierden los electrones de valencia formando de esta forma una nube de electrones entre sus núcleos positivos.
Propiedades
Entre las principales propiedades de los enlaces metálicos podemos mencionar las siguientes:
- Los enlaces metálicos suelen ser solidos a temperatura ambiente, exceptuando el mercurio.
- El punto de ebullición y fusión de los enlaces es muy variado, esto porque los enlaces son muy fuertes.
- Tienen la propiedad de tener un brillo metálico.
- No son frágiles, pero sí poseen gran flexibilidad y además son dúctiles.
- Tienen una buena conductividad de calor y electricidad. Esta propiedad se debe a que los electrones tienen la capacidad de actuar libremente en sus movimientos.
- Suelen ser encontrados como sólidos a temperatura ambiente.
- Son bastante solubles en estado fundido.
Estructura del enlace metálico
En los enlaces metálicos cada átomo se encuentra divididos en doce átomos, seis de ellos se encuentran en el mismo plano, tres están ubicados por encima y tres por debajo. Los electrones son extraídos de sus orbitales por la baja electronegatividad que poseen. Es un enlace de consistencia fuerte, que se forma entre elementos que pertenecen a la misma especie. Pese a que su estructura es muy cercana, pueden interaccionar sus núcleos en las nubes electrónicas, empaquetándose en tres dimensiones, razón por la cual los núcleos están rodeados de dichas nubes.
Teorías
Existen dos diferentes teorías con respecto al enlace metálico que son:
- Teoría del mar de electrones: Es también llamada teoría del gas electrónico y constituye una idea simple del enlace. Dice que la estructura metálica se encuentra conformada por cationes hechos de metal que se encuentran sumergidos en un mar de electrones, y que son estos electrones de valencia los del átomo de un metal y que, además, tienen la capacidad de evitar las diferentes repulsiones electrostáticas que pueden darse entre iones de carga positiva. Explica la conductividad de los metales en la capacidad de movimiento que tienen los electrones. El inconveniente de la teoría es que no logra explicar de forma cuantitativa las conductividades.
- Teoría de las bandas: Esta teoría nace de la aplicación de la mecánica cuántica que poseen los enlaces metálicos. Dice que a partir de dos orbitales atómicos, que corresponden a dos átomos podemos llegar a obtener dos diferentes orbitales moleculares. Entre mayor sea el número de órbitas moleculares menor será la diferencia de energía que haya entre ellos.
Ejemplos de enlace metálico
Los enlaces metálicos pueden y son utilizados en actividades de la vida diaria. Un ejemplo bastante común es el del bronce, que es creado a partir de una aleación de estaño y cobre y es utilizado en la construcción de campanas y estatuas. El acero, formado de carbono y de hierro, es otro ejemplo. Esta aleación hace que el acero sea más fuerte y se puede utilizar en la producción de cocinas y congeladores, construcciones y en la fabricación de puentes.